METTL9 heißt das Enzym, das steht für Methyltransferase like 9, und welche Funktion es hat, war bislang nicht bekannt. Nun konnte es als Protein-Histidin-Methyltransferase identifiziert werden – mithin als ein Enzym, das auf Histidin, eine der Aminosäuren, die Proteine aufbauen, eine Methylgruppe überträgt. Der Methylierung kommt, wie auch anderen chemischen Veränderungen an den Proteinen der Zelle, eine wichtige Rolle zu. Die Aktivität der Proteine bei der Steuerung der Zellfunktionen wird dadurch reguliert und optimiert.
Vor gut 50 Jahren wurde die Protein-Histidin-Mehtylierung schon beschrieben, die das Potenzial hat, viele molekulare Interaktionen und zelluläre Prozesse zu regulieren. Je nachdem, an welcher Stelle die Methylgruppe auf Histidin übertragen wird, kann dieses schließlich in den Formen der beiden Isomere 1- oder 3-Methylhistidin auftreten. Weiter erforscht wurde der biochemische Prozess bislang allerdings jedoch nicht. Mit ihrer Arbeit konnten die Forschenden nun zeigen, dass METTL9 einen Großteil des 1-Methylhistidins in den Zellen generiert.
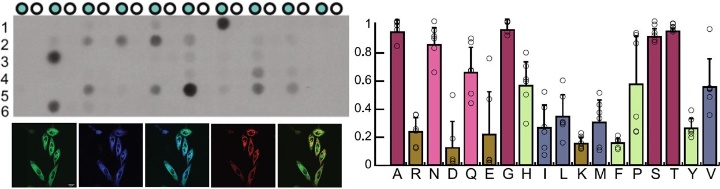
Erkennungssequenz HisxHis-Motiv
Des Weiteren konnten die Stuttgarter Forschenden nachweisen, dass für die durch METTL9-vermittelte Methylierung ein HisxHis-Motiv als Erkennungssequenz notwendig ist. Das heißt, METTL9 wird nur an solchen Stellen des Proteins aktiv und überträgt eine Methylgruppe auf Histidin, wo zwei Histidine (His) aufeinanderfolgen, und zwischen diesen sollte sich vorzugsweise ein kleiner Aminosäurerest (x) befinden.
Für diese Detektivarbeit nutzten die Wissenschaftler die Peptid Array Technologie. Kleinste Proteinmengen, fixiert auf einem Trägermaterial, ermöglichten dabei das schnelle und kostengünstige Testen zahlreicher verschiedener Proteinsequenzen hinsichtlich ihrer Methylierung durch METTL9.
Neue Erkenntnisse können möglicherweise erklären, warum Gendefekte an METTL9 mit Taubheit und entzündlichen Darmerkrankungen korreliert sind und neue Behandlungsansätze für diese Erkrankungen aufzeigen.
Prof. Albert Jeltsch
Push für das zelluläre Kraftwerk
Auch im Hinblick auf die Frage, was die von METTL9 vermittelte Proteinmodifikation bewirkt, wurden die Forscher fündig. Besonders interessant: Die enzymatische Aktivität von METTL9 ist für das optimale Funktionieren der Komplex I-vermittelten mitochondrialen Atmung wichtig. Es handelt sich dabei um einen Teil jener Stoffwechselprozesse, die der Energiegewinnung in der Zelle dienen, und an deren Ende ATP als Energieträger synthetisiert wird. In den Mitochondrien, den Kraftwerken der Zelle, wird durch die Methylierung eines mitochondrialen Proteins die Zellatmung angeregt. In der Folge arbeitet das zelluläre Kraftwerk effizienter und produziert mehr ATP. Diese Beobachtung lässt vermuten, dass zukünftige Arbeiten weitere spannende Einsichten in die biologische Rolle der METTL9 bringen werden. Neue Erkenntnisse können dann möglicherweise erklären, warum Gendefekte an METTL9 mit Taubheit und entzündlichen Darmerkrankungen korreliert sind und damit neue Behandlungsansätze für diese Erkrankungen aufzeigen.
Originalpublikation:
Pål Ø. Falnes et al. The methyltransferase METTL9 mediates pervasive 1-methylhistidine modification in mammalian proteomes, Nature Communications volume 12, Article number: 891 (2021) https://www.nature.com/articles/s41467-020-20670-7
Kontakt:
Prof. Dr. Albert Jeltsch, Universität Stuttgart, Institut für Biochemie und Technische Biochemie (IBTB), Tel.: 0711/ 685-64390, E-Mail


